Soda
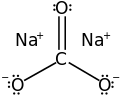
Soda eller natriumkarbonat er saltet efter kulsyres reaktion med natrium og har den kemiske formel Na2CO3.
| Natriumkarbonat | |||
|---|---|---|---|
| IUPAC-navn Natriumcarbonat | |||
| Generelt | |||
| Molekylformel | Na2CO3 | ||
| Molarmasse | 105.9884 g/mol | ||
| Fremtræden | Hvidt fast, hygroskopisk | ||
| CAS-nummer | |||
| EC-nummer | 207-838-8 | ||
| PubChem | |||
| Kemiske egenskaber | |||
| Massefylde | 2.54 g/cm3 | ||
| Opløselighed i vand | 22 g/100 ml (20 °C) | ||
| Smeltepunkt | 851 °C | ||
| Kogepunkt | 1600 °C | ||
| Basestyrkekonstant (pKb) | 3.67 | ||
| Struktur | |||
| Molekylær form | Trigonal, bipyramidal | ||
| Sikkerhed | |||
| MSDS | S3242 | ||
| EU klassifikation | Lokalirriterende (Xi) | ||
| NFPA 704 | |||
| R-sætninger | R36 | ||
| S-sætninger | S2, S22, S26 | ||
| Flammepunkt | Ikke brændbart | ||
| Beslægtede stoffer | |||
| Andre anioner | Natriumbicarbonat | ||
| Andre kationer | Lithiumcarbonat Kaliumcarbonat Rubidiumcarbonat Cæsiumcarbonat | ||
| Relaterede forbindelser | Ammoniumcarbonat Natriumpercarbonat | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
Den almindelige soda forhandles som krystalsoda, et produkt, hvor sodaen fremtræder som klare krystaller. Desuden sælges soda ofte som kalcineret Soda. Kalcineret Soda er tre gange stærkere end almindelig soda. Det dannes ved opvarmning af natron, hvorved der fraspaltes vand og kuldioxid:
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Carbonationen CO32- er en middelstærk base med en dissociationskonstant på pK2=10.34.
Soda må ikke forveksles med kaustisk soda (natriumhydroxid), som er en stærkt ætsende base.
Anvendelse
redigérDet indgår som råstof i produktionen af glas, papir, sæbe, opvaskemiddel, polymer, deriblandt kunstfibre som nylon.
Kilder
redigérNiels Bjerrum og A. Tovborg Jensen (1956) Lærebog i uorganisk kemi D.S.R. forlag og boghandel. Kgl. Veterinær og Landbohøjskole. Der er anvendt 6. udgave (1956), som er et fotografisk optryk af 5. udgave fra 1946 (med mindre rettelser). Carbonater er beskrevet på siderne 177-183.
| Spire Denne artikel om kemi er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |