Propansyre
Kemisk forbindelse
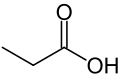
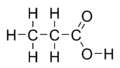
Propansyre er en naturligt forekommende carboxylsyre med den kemiske formel CH3CH2COOH. Propansyre har trivialnavnet propionsyre, af græsk protos ("først") og pion ("fedt"), hvilket hentyder til, at propansyre er den mindste carboxylsyre med fedtsyrelignende egenskaber. Propansyre fremstår under standardbetingelser som en farveløs væske med en ubehagelig lugt. Propansyres korresponderende base kaldes propanoat eller propionat og har formlen CH3CH2COO−. Salte og estre af propansyre kaldes ligeledes propanoater eller propionater.
| Propansyre | |||
|---|---|---|---|
| Generelt | |||
| Systematisk navn | Propansyre | ||
| Andre navne | Propionsyre Ethancarboxylsyre | ||
| Fremtræden | Farveløs, olieagtig væske | ||
| CAS-nummer | |||
| PubChem | |||
| SMILES | CCC(=O)O | ||
| DrugBank | DB03766 | ||
| E-nummer | E280 | ||
| Kemiske egenskaber | |||
| Massefylde | 0,9882 g/cm3[1] | ||
| Opløselighed i vand | 8,19 g/g (−28,3 °C) 34,97 g/g (−23,9 °C) Blandbar (≥ −19,3 °C)[2] | ||
| Opløselighed | Blandbar med ætanol, diethylether og kloroform[3] | ||
| Smeltepunkt | −20,5 °C (252,65 K)[1] | ||
| Kogepunkt | 141,15 °C (414,3 K)[1] | ||
| Syrestyrkekonstant (pKa) | 4,87[1] | ||
| Refraktionsindeks | 1,3809[1] | ||
| Viskositet | 1,175 cP (15 °C)[4][5] 1,02 cP (25 °C)[4] 0,668 cP (60 °C)[4] 0,495 cP (90 °C)[4] | ||
| Struktur | |||
| Krystalstruktur | Monoklin (−95 °C)[6] | ||
| Dipolmoment | 0,63 D (22 °C)[5] | ||
| Termokemi | |||
| DeltaHf | −510,7 kJ/mol[1] | ||
| Std. entalpi af forbrænding ΔcH | 1527,3 kJ/mol[5][7] | ||
| Std. molar entropi S | 191,0 J/(mol·K)[1] | ||
| Std. molar varmekapacitet, cp | 152,8 J/(mol·K)[1] | ||
| Sikkerhed | |||
| Største risici | Ætsende (C) | ||
| NFPA 704 | |||
| R-sætninger | R10, R34 | ||
| S-sætninger | S1/2, S23, S36, S45 | ||
| Flammepunkt | 54 °C (327 K)[8] | ||
| LD50 | 1370 mg/kg (oralt, mus)[3] | ||
| Beslægtede stoffer | |||
| Andre anioner | Propanoat | ||
| Andre carboxylsyrer | Eddikesyre Mælkesyre Pyrodruesyre 3-Hydroxypropansyre Tartronsyre Akrylsyre Smørsyre | ||
| Relaterede forbindelser | 1-Propanol Propanal Natriumpropanoat Propansyreanhydrid | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
Referencer
redigér- ^ a b c d e f g h Andersen, Erik Strandgaard; Jespergaard, Paul; Østergaard, Ove Grønbæk. DATABOG fysik kemi, 11. udgave, pp. 122-123. København: F & K forlaget, 2009. ISBN 978-87-87229-61-6.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2. udgave). D. Van Nostrand Company. s. 569. (engelsk)
- ^ a b http://chemister.ru/Database/properties-en.php?dbid=1&id=1485. Besøgt 6. oktober 2016. (engelsk)
- ^ a b c d "Propionic Acid" på PubChem Open Chemistry Database. Besøgt 6. oktober 2016. (engelsk)
- ^ a b c Lagowski, J.J., red. (2012). The Chemistry of Nonaqueous Solvents. Vol. III. Elsevier. s. 362. ISBN 0323151035. (engelsk)
- ^ Strieter, F. J.; Templeton, D. H.; Scheuerman, R. F.; Sass, R. L. (1962). "The crystal structure of propionic acid". Acta Crystallographica. 15 (12): 1233-1239. doi:10.1107/S0365110X62003278. (engelsk)
- ^ "Propanoic acid". I: Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg, MD. http://webbook.nist.gov. Websted besøgt 6. oktober 2016. (engelsk)
- ^ "Propionic acid" på kemikalieleverandøren Sigma-Aldrichs hjemmeside. Besøgt 6. oktober 2016. (engelsk)