Dipol
En dipol er en elektromagnetisk størrelse, som har to poler. Der kan være tale om en elektrisk dipol, som består af to lige store ladninger med modsat fortegn tæt på hinanden - eller en magnetisk dipol, der dannes af lukkede strømme.
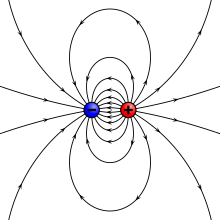

Dipoler anvendes i radioantenner i form af en elektrisk dipolantenne og magnetisk dipolantenne - fødet med vekselstrømme.
Molekylære dipoler
redigérMange molekyler har dipolmomenter som skyldes at positive og negative ladninger på de forskellige atomer ikke er ensartet fordelt over hele molekylet. For eksempel:
- (positiv) H-Cl (negativ)
Et molekyle med et permanent dipolmoment kaldes et polært molekyle. Et molekyle bliver polariseret når det bærer en induceret dipol. Kemikeren Peter Debye var den første som studerede molekylære dipoler i detaljer, og dipolmomenter bliver målt i enheden debye, opkaldt efter ham.
Der findes forskellige typer af dipoler i molekyler:
- Permanente dipoler: når to atomer i et molekyle har væsentligt forskellig elektronegativitet; det ene atom tiltrækker elektroner mere end det andet, og bliver derfor mere negativt. Det andet atom bliver tilsvarende mere positivt.
- Inducerede dipoler Disse forekommer når et molekyle med en permanent dipol frastøder det andet molekyles elektroner, således at der "induceres" et dipolmoment i det andet molekyle. Der kan også induceres et dipolmoment ved at placere molekylet i et elektrisk eller et magnetisk felt.
Typiske værdier for gasfasen af nogle kemiske forbindelser, angivet i debye-enheder er: [1]:
- kuldioxid: 0
- kulmonoxid: 0,112
- ozon: 0,53
- fosgen: 1,17
- vanddamp: 1,85
- hydrogencyanid: 2,98
- cyanamid: 4,27
- kaliumbromid: 10,41
Disse værdier fås ved at måle den dielektriske konstant. Når symmetri i et molekyle betyder at det ikke har et nettodipolmoment, sættes værdien til 0. De højeste dipolmomenter ligger omkring 10-11 D. Man kan udlede information om molekylets geometry når dipolmomentet kendes. F.eks. illustrerer ovenstående data at kuldioxid er et lineært molekyle, mens ozone ikke er.
Kilder
redigér- ^ Weast, Robert C. (1984). CRC Handbook of Chemistry and Physics (65 udgave). CRC Press. ISBN 0-8493-0465-2.
| Spire Denne naturvidenskabsartikel er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
